|
Η Επιτροπή για Φαρμακευτικά Προϊόντα Ανθρώπινης Χρήσης (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων (EMEA) ανακοίνωσε ότι σε σύσκεψή της στις 16-19 Φεβρουαρίου 2009 εξέδωσε θετική γνωμάτευση για την κυκλοφορία των παρακάτω νέων φαρμάκων:
Conbriza (bazedoxifene) της Wyeth Europa Ltd, για τη θεραπεία της μετεμμηνοπαυσιακής οστεοπόρωσης σε γυναίκες με αυξημένο κίνδυνο κατάγματος.
Exalief (eslicarbazepine acetate) και Zebinix (eslicarbazepine acetate) της BIAL-Portela & C, S.A., ως πρόσθετη θεραπεία σε ενήλικες με εστιακές επιληπτικές κρίσεις, με ή χωρίς δευτερογενή γενίκευση.
Pantozol Control, Controloc Control, Somac Control, Pantecta Control και Pantoloc Control (pantoprazole) της Nycomed GmbH., για μικρής διάρκειας θεραπεία των συμπτωμάτων γαστροοισοφαγικής παλινδρόμησης (π.χ., οπισθοστερνικός καύσος, αναγωγές γαστρικού οξέος) σε ενήλικες.
Removab (catumaxomab) της Fresenius Biotech GmbH., για την ενδοπεριτοναϊκή θεραπεία κακοήθων ασκιτών σε ασθενείς με «Ep-CAM»-θετικά καρκινώματα, όπου η συμβατική θεραπεία δεν είναι διαθέσιμη ή καθίσταται μη εφαρμόσιμη.
Οι αποφάσεις της CHMP παραπέμφθηκαν στην Ευρωπαϊκή Επιτροπή προκειμένου να χορηγηθεί η άδεια κυκλοφορίας για τα νέα φαρμακευτικά προϊόντα.
|
Διαβάστε επίσης
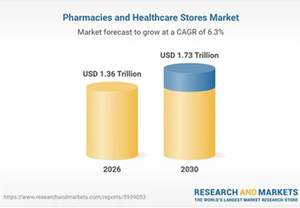
20/2/2026 4:55:44 μμΆνω του $1,5 τρισ. η παγκόσμια αγορά του φαρμάκου και του παραφαρμάκου
Οι χρόνιες ασθένειες βασικός μοχλός ανάπτυξης
20/2/2026 4:54:39 μμKarabinis Group SA: Σύσταση νέου εταιρικού σχήματος
Στόχος η ενιαία κατεύθυνση και η μακροπρόθεσμη σταθερότητα